李四香,周承志 ,李为民
摘要
树突状细胞是链接固有、适应性免疫的桥梁,触发肿瘤免疫反应的扳机。不同亚型 的 DC发挥着不同的抗肿瘤功能。基于树突状细胞的重组疫苗和免疫调节剂业已取得一定的疗效,有潜力成为肺癌免疫治疗新方向。本文简要讨论了人体 DC的来源、分类、功能,强调了 DC在肺癌微环境的重要作用,以及基于不同类型DC的肺癌免疫治疗的最新发现。
关键词:树突状细胞,肺癌,免疫治疗
树突状细胞来源、分类
树 突 状 细 胞 (Dendritic cell,DC)起 源 于 骨 髓 造 血 干 细 胞
(Hematopoietic stem cells,HSC),成熟时伸出许多树突样或伪足样突起,以不同形式分布在各类组织中,以淋巴组织居多[1]。树突状细胞分类复杂,主要根据来源、形态、位置、功能、表面标志物、标记基因及是否成熟分类。目前发现成熟 DC主要有两大类:来源于淋巴样干细胞的 DC(plasmacytoidDC,pDC)和来源于髓样干细胞DC(myeloid DC,mDC)[2]。pDC因静息状态下形态与浆细胞相似而得名,主要存在与血液及淋巴组织中,通过血液循环进入淋巴组织,并表达少量 II型组织相容性抗原(major histocompatibility complex classII,MHC-II)及大量 CD303(BDCA2)、颗粒酶 B(GranzymeB)、CD123等相对特异膜表面蛋白。mDC主要包括了 I型及 II型经典(传统)树突状细胞(classical/conventional DC,cDC)。cDC表达大量 I型组织相容性抗原(majorhistocompatibilitycomplexclassI,MHC-I)及 MHC-II分子,分别识别和处理内源性及外源性抗原(antigen,Ag),递呈并激活初始 T淋巴细胞(naiveTcell)、B淋巴细胞、NK细胞等,启动机体对病毒、肿瘤细胞、细菌及真菌等发挥免疫效应[2,3]。cDC对 Ag具有 “交叉呈递”能力,即 cDC的 MHCI能提呈外源性抗原,而 MHCII能提呈内
源性抗原。cDC根据细胞表面分子标志,主要分为 CD141+ (BDCA3+) cDC1 和 CD1c+(BDCA1+)cDC2亚型[4]。此外,由单核细胞原位分化而来的单核-树突状细胞(monocyte-derived dendriticcell,Mo-DC)在机体接受 Ag刺激引发炎症反应时,向淋巴结迁移并递呈相应抗原[5]。胚胎来源并聚居于特定组织的朗格汉斯细胞(Langerhans cell,LC)是人类特殊的不成熟树突状细胞,主要存在于皮肤表皮、口腔以及气管、食管粘膜、淋巴样器官等,表达 CD45、MHC-II、CD1a及特异性 Langerin分子,对皮肤、粘膜的屏障功能意义非凡(见图 1)[6]。
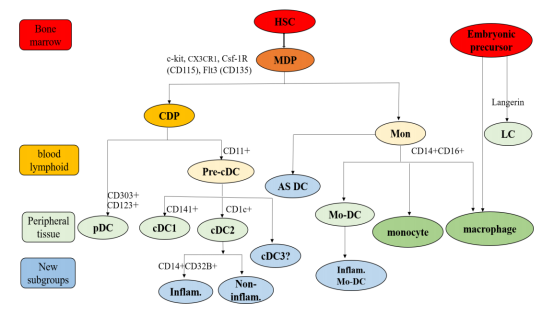
图 1 树突状细胞起源与分类
近年来,对 DC新类型及功能的探索层出不穷。基于健康人外周血的单细胞测序技术、流式细胞术分析结果提示,人类 DC可以大致划分 6种亚型,其中经典树突状细胞可分为 3个亚型:cDC1(分子标志:CD141,XCR1,CLEC9A,TBHD,CADM1), cDC2(分 子 标 志 CD1C,CD1A,CD1E,CD207,CD36,CD163),cDC3(分子标志CD1C,CD1A,CD1E,CD207,CD32B,CD36,CD163)。其中,CD1C+DC细分为 CD32B高表达(non-inflammatory type,cDC3)及 CD32B低表达亚型(inflammatory type,cDC2)。其中,cDC3高表达急、慢性炎症标志物如 CD14、S100A9和 S100A8。Mo-DC分为 2个亚型:经典型 CD1C–CD141–CD11C+Mo-DC与新型ASDC(分子标志:AXL,SIGLEC1,SIGLEC6,CD22/SIGLEC2)。ASDC既表达 pDC某些分子标志物,亦表达某些 cDC分子标志物,促进 CD4+和 CD8+T细胞的分化,其具体功能仍有待探索[7]。基于 NSCLC肺组织的单细胞测序技术、流式细胞术分析结果新发现与“静止型”cDC1、cDC2同源的“活化型”cDC3(分子标志物:FSCN1,CCR7,LY75,CCL22,BIRC3,BATF3,IRF8)(见图 1)[8]。
pDC、cDC由 树 突 状 细 胞 共 同 前 体 细 胞 (the common DC progenitor, CDP)在骨髓中分化而来,而 CDP与单核细胞均起源于单核-树突状细胞祖细胞(Monocyte-Dendritic cell progenitor,MDP)。近期研究揭示,在人类中,根据 CD172a/SIRPα的表达与否, CDP在骨髓便开始分化为 CD172a+pre-cDC和 CD172a−pre-cDC,迁徙至外周血及淋巴组织分别继续分化为成熟CD1c+cDCs和CD141+cDCs[9]。在淋巴结的树突状细胞可分为“定居型”和“迁徙型”,后者从外周组
织递呈抗原引流至淋巴结触发后续免疫效应[10]。
树突状细胞免疫功能
树突状细胞通过 MHCI及 MHC-II分子识别、吞噬内源和外源性抗原并传递信号,是功能最强的专职抗原呈递细胞,联结固有免疫与适应性免疫[1]。在胸腺中,树突状细胞参与 T细胞的阴性、阳性选择、分化及免疫耐受。在外周非淋巴样组织中,DC细胞捕获内源性或外源性抗原,通过 CCR7趋化引流至淋巴结,递呈抗原至 T淋巴细胞、B淋巴细胞、NK细胞等,引发免疫耐受或者免疫活化效应[11]。未成熟树突状细胞迁移能力较强,从骨髓进入外周血并迁徙至外周组织。成熟细胞则能有效激活初始 T细胞,cDC1s主要分布在外周组织粘膜及血管壁,诱导初始 T细胞分化为 CD8+细胞毒性 T细胞(cytotoxicT-cell,CTL),发挥效应。cDC2s则主要分布外周组织固有层,吞噬衰老凋亡细胞使其蛋白水解,主要活化 CD4+Th1、Th2、Th17细胞,分泌大量促炎因子[13]。pDCs广泛分布在肺实质,主要识别内源性抗原如病毒并递呈至 CD8+T细胞,产生大量 I型干扰素(IFN-α),发挥抗病毒作用及免疫耐受[6]。Mo-DCs循环于血液及淋巴组织中,募集在炎症及肿瘤组织,激活 CD4+T、CD8+T细胞,促进 Th17的分化,分泌 IL-6、TNF-α、IL1-β、IL-23等炎症因子发挥抗炎作用(见图 2)[13]。
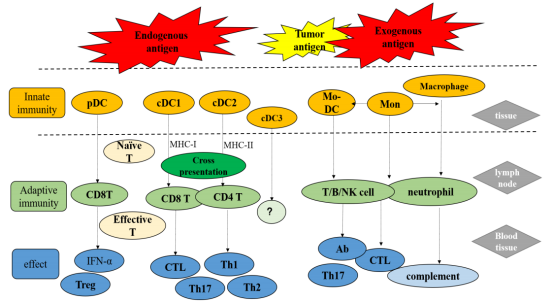
图 2 树突状细胞免疫功能
树突状细胞与肺癌的肿瘤微环境
肿瘤微环境是肿瘤细胞生长及演化的局部环境,浸润着多种免疫细胞,包括肿瘤相关树突状细胞(tumor associated dendritic cell,TADC)[14]。TADC仅占肿瘤微环境免疫细胞 2.1%,在肿瘤组织及淋巴组织中迁徙流动,识别并处理肿瘤相关抗原(tumor associated antigen,TAA),原位递呈或者通过传入淋巴管转移到引流肿瘤的淋巴结中刺激初始 T淋巴细胞分化为肿瘤抗原特异性 T淋巴细胞,上调共刺激分子的表达,并调节细胞、化学因子产生、释放,诱导抗肿瘤免疫应答。这些步骤中的任何一个步骤的失败都会抑制抗肿瘤免疫效应[14,15]。无论是小鼠还是人类实验数据表明,TADC涵盖了几乎所有 DC亚群,各自发挥不同的抗肿瘤免疫效应[16]。CD14+Mo-DC通过 IL-10、IL-1β等促炎因子的分泌及 PD-L1表达的上调抑制肿瘤细胞生长。cDC可从肿瘤部位迁徙至引流淋巴结,激活大量初始 T淋巴细胞分化、成熟,发挥对肿瘤细胞的免疫监视清除作用。 其中 cDC1诱导 CD8+T分化为可识别外源性肿瘤衍生抗原的细胞毒性 T淋巴细胞(CTL),分泌高水平IL-12、IL-23、IL-10等抗炎因子[17];cDC2诱导 CD4+T分化 Th1、Th2、Th17等细胞,促进 IL-6、IL-4、TNF-α、IL-17等炎症因子大量释放[2,10]。实验数据表明,与远癌对照组织相比,肺癌组织 cDC1、 cDC2显著减少[18]。注射 cDC1疫苗的小鼠抗肿瘤 CTL急剧升高,肿瘤体积显著缩小,注射了 cDC2疫苗的小鼠,肿瘤体积也有一定程度缩小[14]。
树突状细胞的缺失对于肿瘤的免疫逃逸及免疫治疗失效作用关键。肿瘤免疫逃逸的重要机制之一是将 DC维持在未成熟或免疫抑制状态,损害了它们作为 APC的功能,从而使这些细胞无法刺激肿瘤抗原特异性 T细胞分化[15]。肿瘤细胞通过分泌 IL-10(抑制 DC成熟及其分泌 IL-12的能力)、IL-6(增强 STAT3通路信号转导)等下调 DC表面 MHC-II、CCR7的表达,干扰 DC的抗原呈递能力[19]。肿瘤组织浸润的 Treg细胞亦会显著抑制 cDC2抗原递呈、诱导 CD4+T细胞分化功能[10]。总之,肿瘤微环境中 cDC1、cDC2的数量减少及功能受抑制和 Treg细胞的增多与肺癌患者预后不良显著相关(见图 3)[10]。
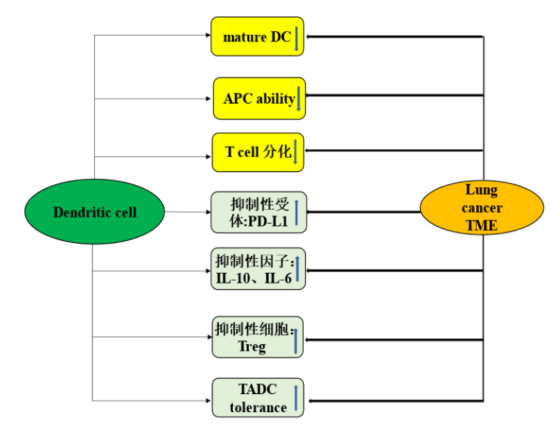
图 3 肿瘤微环境对树突状细胞功能影响
因此,通过 DC疫苗注射的方式以期恢复、增强 DC对肿瘤组织的免疫作用是目前癌症免疫治疗研究的热点。多项动物及临床试验揭示,纯化的 TA-cDC1疫苗显著增加效应 T细胞募集,并与化疗及PD-1/PD-L1、CD137单克隆抗体(mAb)治疗等具有协同作用[20,21]。在黑色素瘤患者中,多项临床研究已证实 cDC2s疫苗安全有效[22,23]。
基于树突状细胞的肺癌免疫治疗利用 DC免疫原性在癌症患者中诱导保护性反应的概念已提出多年,基于 DC细胞的个体免疫疗法在多种肿瘤亦有大量探索及尝试[24]。
1.Mo-DC
基于可用性和体外扩增等技术方面,Mo-DC最常用于疫苗接种目的。相较其他 DC亚型,Mo-DC更容易在体外通过粒系-巨噬集落刺激因子(granulocyte macrophage colony-stimulating factor,GM-CSF)及 IL-4刺激外周血中 CD14+单核细胞或者 CD34+HSPCs分化而大量产生[26,27]。然而,既往临床试验表明,Mo-DC疫苗效果与预期仍有差距,原因可能是体外经 GM-CSF及 IL-4诱导分化、培养的 Mo-DC与天然的 Mo-DC在基因表达及免疫功能有所差异[30],此外,体外培养的 Mo-DC迁徙能力及细胞因子的分泌(IL12、 IFN-γ)亦受限[14]。因此,在诱导抗肿瘤免疫应答方面,Mo-DC疫苗是否优于其他DC亚型,尚不清楚,并且可能取决于肿瘤类型和肿瘤微环境的组成。
2. cDC
cDC1在肿瘤免疫监视中意义重大,cDC1诱导分化的肿瘤特异性CD8+CTL、NK和 NKT对肿瘤细胞具有直接或间接杀伤作用,是生产疫苗绝佳的选择[14,28]。近年来,单细胞测序技术分析结果表明 cDC1与抑制性配体如 PD-L1表达增高、NSCLC不良预后紧密相关[28,29]。目前对 cDC1在肿瘤免疫监视中的作用以及免疫疗法仍在进一步探索中[27]。
cDC2虽不如 cDC1瞩目,其诱导分化的 Th17的肿瘤免疫调节作用愈发受到重视[32]。从人外周血分离培养的 cDC2疫苗已在临床上证实改善部分黑色素瘤病人预后,在肺癌中的应用有待更多的研究[23]。
3. pDC
首个pDC疫苗临床试验纳入15名黑色素瘤患者,外周血分离pDC体外培养、刺激、分化后回输体内并产生IFN-α,观察到CD4+淋巴细胞和CD8+T淋巴细胞活化[22]。尽管目前相关研究不多,pDC在肿瘤中的作用机制逐渐引起重视[30],pDC疫苗具有潜在的抗肿瘤能力[31]。
4. 混合 DC疫苗
每类 DC亚群通过不同机制发挥着免疫效应, 单种类的 DC疫苗在某些特定肿瘤及人群中证实有效。随着体外 DC细胞的诱导、分化、培养更精确化,混合型的 DC疫苗效果值得期待[32]。此外,基于纳米技术,载有肿瘤抗原的小分子免疫调节剂,通过在体内刺激内源性 DC产生亦是肿瘤免疫治疗热点[24]。
总结与展望
树突状细胞(DCs)专职递呈TAA至初始T淋巴细胞并诱导其分化为效应T细胞,为肿瘤的免疫治疗提供契机。近年来,单细胞测序技术结合流式细胞术在树突细胞分群及功能鉴定,以及阐明它们在TME中作用机制中有诸多发现与探索。有研究曾通过收集、培养肺癌胸腔积液中DC前体细胞,加入GM-CSF、IL-4及TNF-α诱导分化为成熟的DC。结果显示,培养成熟的DC对自体癌细胞有较强的杀伤作用[33]。虽然基于树突状细胞的肺癌免疫治疗处于起步阶段,但有望成为肺癌免疫治疗的靶点。
参考文献
1 MildnerA, JungS.Development and function of dendritic cell subsets[J]. Immunity,2014,40(5):642-56.
2 CollinM, BigleyV.Human dendritic cell subsets:an update[J].Immunology,
2018,154(1):3-20.
3 ChistiakovDA, SobeninIA, OrekhovAN,etal.Myeloid dendritic cells :Development, functions, and role in atherosclerotic inflammation[J].Immunobiology,2015,220(6):833-44.
4 GuilliamsM,GinhouxF,JakubzickC,etal.Dendritic cells,monocytes and macrophages: a unified nomenclature based on ontogeny[J].NatRevImmunol,
2014,14(8):571-8.
5 DominguezPM,ArdavinC.Differentiation and function of mouse monocyte-derived dendritic cells insteady state and inflammation[J].Immunol Rev,2010,234(1):90-104.
6 CollinM,McgovernN,HaniffaM.Human dendritic cell subsets[J]. Immunology,2013,140(1):22-30.
7 VillaniAC,SatijaR,ReynoldsG,etal.Single-cell RNA-seq reveals new types Of human blood dendriti ccells,monocytes,and progenitors[J].Science,2017,356(6335):
8 ZilionisR,EngblomC,PfirschkeC,etal.Single-Cell Transcriptomics of Humanand Mouse Lung Cancers Reveals Conserved Myeloid Populations Across Individuals and Species[J].Immunity,2019,50(5):1317-34.e10.
9 BretonG,ZhengS,ValierisR,etal.Human dendritic cells(DCs) are derived From distinct circulating precursors that are precommitted to become CD1c+or CD141+DCs[J].J ExpMed, 2016,213(13):2861-70.
10 BinnewiesM,MujalAM,PollackJL,etal.UnleashingType-2Dendritic Cells To Drive Protective Antitumor CD4(+)T Cell Immunity[J].Cell,2019,177(3):556-71e16.
11 EisenbarthSC.Dendritic cell subsets in Tcell programming:location Dictates function[J]. Nature Reviews Immunology,2019,19(2):89-103.
12 MeradM,SatheP,HelftJ,etal.The dendritic cell lineage:ontogeny and Function of dendritic cells and their subsets in the steady state and the inflamed setting[J].Annu Rev Immunol,2013,31(563-604.
13 ShindeP,FernandesS,MelinkeriS,etal.Compromised functionality of monocyte-derived dendritic cells in multiple myeloma patients may limit their use in cancer immunotherapy [J].Scientific Reports,2018,8
14 LaouiD,KeirsseJ,MoriasY,etal.The tumour microenvironment harbours Ontogenically distinct dendritic cell populations with opposing effects on tumour immunity[J].Nat Commun,2016,7(13720.
15 Bandola-SimonJ,RochePA.Dysfunction of antigen processing and Presentation by dendritic cells in cancer[J].MolImmunol,2019,113(31-7.
16 KissM,VanGassenS,MovahediK,etal.Myeloid cell heterogeneity in cancer:not a single cell alike[J].CellImmunol,2018,330(188-201.
17 DiBlasioS,WortelIM,VanBladelDA,etal.HumanCD1c(+)DCs are critical Cellular mediators of immune responses induced by immunogeni ccell death[J]. Oncoimmunology,2016,5(8):e1192739.
18 GabrilovichD.Mechanisms and functional significance of tumour-induced
dendritic-cell defects[J].Nat Rev Immunol,2004,4(12):941-52.
19 LuY,XuW,GuY,etal.Non-small Cell Lung Cancer Cells Modulate the
DevelopmentofHumanCD1c Conventional Dendritic Cell Subsets MediatedbyCD103andCD205[J].
20 SalmonH,IdoyagaJ,RahmanA,etal.Expansionand Activation of CD103(+)
Dendritic Cell Progenitors at the Tumor Site Enhances Tumor Responses to
TherapeuticPD-L1andBRAFInhibition[J].Immunity,2016,44(4):924-38.
21 Sanchez-PauleteAR,CuetoFJ,Martinez-LopezM,etal.Cancer Immunotherapy with Immuno modulatory Anti-CD137andAnti-PD-1 Monoclonal Antibodies Requires BATF3-Dependent Dendritic Cells[J].Cancer Discov,2016,6(1):71-9.
22 TelJ,AarntzenEH,BabaT,etal.Natural human plasmacytoid dendritic Cells induce antigen-specificT-cellresponsesinmelanomapatients[J].Cancer Res,2013,73(3):1063-75.
23 SchreibeltG,BolKF,WestdorpH,etal.Effective Clinical Responses in Metastatic Melanoma Patients after Vaccination with Primary Myeloid Dendritic Cells[J].Clin Cancer Res,2016,22(9):2155-66.
24 WculekSK,CuetoFJ,MujalAM,etal.Dendritic cells in cancer immunology And immunotherapy[J].Nat Rev Immunol,2020,20(1):7-24.
25 PerezCR,DePalmaM.Engineering dendritic cell vaccines to improve Cancer immunotherapy[J].Nat Commun,2019,10(1):5408.
26 SaxenaM,BalanS,RoudkoV,etal.Towards superior dendritic-cell vaccines For cancer therapy[J].Nat BiomedEng,2018,2(6):341-6.
27 HuberA,DammeijerF,AertsJ,etal.Current State of Dendritic Cell-Based Immunotherapy : Opportunities for invitro Antigen Loading of Different DC Subsets?[J].Front Immunol,2018,9(2804.
28 CancelJC,CrozatK,DalodM,etal.Are Conventional Type1 Dendritic Cells Critical for Protective Antitumor Immunity and How?[J].Frontiers in Immunology,2019,10
29 ZilionisR,EngblomC,PfirschkeC,etal.Single-Cell Transcript omics of Human and Mouse Lung Cancers Reveals Conserved Myeloid Populations Across Individuals and Species[J]. Immunity,2019,50(5):1317
30 LuY,XuW,GuY,etal.Non-small Cell Lung Cancer Cells Modulate the Development of HumanCD1c(+)Conventional Dendritic Cell Subsets Mediated By CD103 and CD205[J].FrontImmunol,2019,10(2829.
31 陈桂思,王悦,吴婉文,etal.浆细胞样树突状细胞与肿瘤免疫 [J].广东药科大学学报,2018,34(04):533-7.
32 ReinigerL,TeglasiV,PipekO,etal.Tumor necrosis correlates with PD-L1And PD-1 expression in lung adenocarcinoma[J].ActaOncol,2019,58(8):1087-94.
33 李彩霞,苏秀兰,李国华,etal.肺癌胸腔积液树突状细胞培养与鉴别及其抗肿瘤作用的观察 [J].中华肿瘤防治杂志,2012,19(21):1640-2+69.
